Herstellung und Labore
Am Herstellungsprozess von Bakteriophagenzubereitungen sind beteiligt
- die Mikrobiologie, die das Bakterium aus dem Abstrich des Patienten isoliert, den Bakterienstamm identifiziert und auf Antibiotika-Resistenzen prüft (Antibiogramm),
- eine Phagenbank, einen oder mehrere Phagen identifiziert, der/die speziell dieses Bakterium angreifen
- ein Phagenlabor, das diese Phagen nochmals auf Geeignetheit testet, sie vermehrt und aufreinigt, und aus dem Phagenlysat eine Grundlösung herstellt, und
- die (Klinik-)Apotheke, die daraus das Arzneimittel nach Rezept für den Patienten herstellt.
Phagenlabor
Das Phagenlabor wird zunächst aus einer hauseigenen oder fremden Phagenbank einen oder mehrere Phagen identifizieren, die speziell – und nur – den vorgefundenen Bakterienstamm infiltrieren und lysieren können. Dafür gibt es mehrere Methoden:
- Die einfachste Methode ist die Durchführung eines klassischen Plaque-Essays auf einem Indikatorstamm. Dafür muss zunächst der Bakterienrasen gezüchtet werden. Für eine schnelle Identifizierung im Notfall ist diese Methode daher nicht geeignet.
- Sodann kommt eine phagenspezifische PCR-Testung in Betracht, die auf einer Vervielfältigung von Genbereichen beruht, die nur bei diesem Phagen zu finden sind. Eng verwandte Phagen, die ungeeignet sind, können dadurch aber nicht sicher ausgeschlossen werden.
- Die genaueste, aber auch teuerste Methode ist die Sequenzierung des gesamten Phagen-Genoms. Der Vorteil liegt vor allem darin, dass die Reinheit des Phagenlysats analysiert werden kann, also eine Kontamination durch Mikroorganismen ("bioburden" bzw. "Sterilität") und prozessbedingte Verunreinigungen, vor allem Proteine der zerstörten Wirtszellen und Endotoxine, analysiert werden kann.
Durch die Sequenzierung kann z.B. auch festgestellt werden, ob die isolierten Phagen bereits DNA- Informationen ihres Wirtsbakteriums ("host") in die eigene DNA aufgenommen haben, etwa Antibiotika-Resistenzgene, die durch die Phagentherapie dann erstmalig in das Mikrobiom des Patienten eingetragen werden könnten. Das möchte man natürlich vermeiden. Andererseits wird die Antibiotika-Resistenz der humanpathogenen Bakterien zunehmend unerheblich, wenn und soweit die Phagentherapie die chemischen Antibiotika ablösen wird.
Durch Sequenzierung (PCR oder volle Genom-Sequenzierung) können ferner solche Phagen aus dem Pool ausgesondert werden, die keine lytische Effizienz aufweisen (sog. " lysogene" Phagen). Diese Phagen können zwar das Bakterium infiltrieren, werden aber in ihrem Wirt nur eingelagert und führen nicht zu einer Zerstörung des Bakteriums. Therapierelevant sind daher nur die lytischen Phagen, und nur die sollen daher vermehrt werden.
Für eine flächendeckende Versorgung der Bevölkerung werden allerdings solche Mengen an Sequenzern benötigt, die derzeit undenkbar sind. Eine vollständige Genomsequenzierung kommt daher in der Praxis allenfalls zu Forschungszwecken in Betracht. Die Herstellung und Vermehrung auf den pathogenen Wirtszell-Stämmen durch Plaque-Essay wird daher nach wie vor von internationalen Gremien von Wissenschaftlern als ausreichend sicher angesehen und ist daher derzeit state-of-the-art.
Nicht so leider das BfArM, das dem Fraunhofer ITEM die Herstellung von Phagen für die Studien phagoflow und phage4cure unter voller Genomsequenzierung unter GMP-Bedingungen vorgeschrieben hat. Damit weicht das BfArM nicht nur von der Empfehlung internationaler Experten ab, die der Meinung sind, dass dies für die Therapie keinerlei Mehrwert bringt, sondern hat auch gleich die beiden einzigen deutschen Studien zur Effizienz von Phagen im Keim erstickt. Wegen der enormen Kosten (€ 200.000,-/Präparat anstelle von € 1.000,- bis 10.000,-/Präparat) sind sie von Anfang an unterfinanziert: An Stelle der Mindest-Anzahl von Phagen (6 pro Bakterium) können nur maximal 3 analysiert und produziert werden. Damit verlieren die Studien möglicherweise an Aussagefähigkeit. Am Ende wird es – wie bereits in einigen handwerklich zweifelhaft designten Studien zuvor – von interessierter Seite wieder heißen "die Effizienz von Phagen konnte nicht nachgewiesen werden".
Die isolierten, lytischen Phagen werden sodann auf den pathogenen Wirtszell-Stämmen vermehrt. Dabei zerfallen Millionen von Bakterien und hinterlassen Proteinreste und Endotoxine im Lysat. Das Phagenlysat wird daher anschließend in einem aufwändigen Filtrationsprozess aufgereinigt.
Nach mehrfacher Filtration wird sodann ein – möglichst stabiles – Phagenlysat hergestellt. Die Stabilität der Phagen nimmt mit steigendem Reinheitsgrad allerdings ab, sodass ein gewisses Residuum an host-Proteinen erwünscht ist. Getestet wird die Reinheit schließlich anhand der Farbe und der Klarheit der Flüssigkeit.
Die Vorgehensweise hat das Team des Fraunhofer-Instituts für Toxikologie und Experimentelle Medizin, Braunschweig, in der Zeitschrift Pharmakon , Heft 6/2021, wie folgt beschrieben:
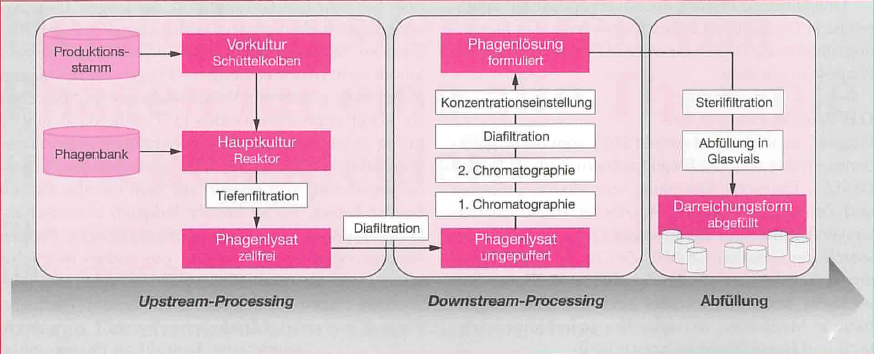
Der Zeitaufwand liegt bei ca. 2 Wochen, sofern nicht zuvor eine aufwändige Phagensuche notwendig wird. Wenn die örtliche Phagenbank keine passenden Phagen vorhält, findet eine externe Suche statt, d.h. es werden auswärtige Phagenbanken angefragt (z.B. über die Plattform www.phage.directory in Sydney). Gleichzeitig werden aus örtlichen Ge- und Abwässern Proben genommen, wobei die Abwasseranlagen der Kliniken am erfolgversprechendsten sind. Idealerweise nimmt man Proben aus den Abwässern der betroffenen Klinik, in der der Patient mit dem Keim in Kontakt gekommen war. Denn dort, wo das Bakterium ist, findet sich immer auch der passende Phage. Die Suche kann je nach Problemkeim u.U. mehrere Wochen in Anspruch nehmen. Der Erfolg hängt daher u.U. am Zeitfaktor . Eine frühzeitige Anfrage durch die behandelnden Ärzt+innen ist daher ganz essenziell.
Das Fraunhofer ITEM ist derzeit das einzige Phagenlabor in Deutschland; aufgrund der obstruktiven Haltung des BfArM verfügt es allerdings nicht über eine brauchbare Herstellungserlaubnis. Derzeit wird geprüft, ob nicht genom-sequenzierte Phagenlösungen zumindest in Fällen des compassionate use an Kliniken abgegeben werden können. Das Fraunhofer ITEM sieht sich jedoch an der Abgabe rechtlich gehindert. PhageGermany hat beim BfArM angefragt; eine Antwort steht jedoch noch aus.
Der Europäischen Zulassungsbehörde EMA liegt demgegenüber die Herstellungsmonographie des Instituts für Mikrobiologie am Queen-Astrid-Military-Hospital (QAMH) in Brüssel vor. Dieses Institut verfügt bereits über eine Herstellungserlaubnis der belgischen Behörden für die Herstellung von Phagen ohne GMP-Genomsequenzierung; es hat inzwischen die Erlaubnis für die herkömmliche Herstellungsmethode auch auf EU-Ebene beantragt. Sollte die EMA dem folgen, wird das BfArM einlenken müssen. Bis dahin müssen die Phagen weiterhin über das QAMH besorgt werden.
Eine Übersicht über die weltweit formulierten Monographien findet sich bei Danielle L. Peters und Greg Harris https://doi.org/10.1002/cpz1.594
Die Belgische Monographie steht im download für Sie bereit.
Wir möchten an dieser Stelle dem Team um Herrn Prof. Pirnay und Herrn Dr. Verbeken vom QAMH einen großen Dank aussprechen, weil sie unglaublich kooperativ sind und schon einigen Patienten in Deutschland das Leben gerettet haben. So auch dem Neugeborenen der Kinderklinik Hamburg-Eppendorf, das bei einer Lebertransplantation mit einem antibiotikaresistenten Enterococcus faecum (VRE) infiziert wurde und nur mit Hilfe des QAMH gerettet werden konnte, und zwar ohne Genomsequenzierung (s. case-report 2021: https://www.mdpi.com/1999-4915/13/9/1785 )
Es ist eine der größeren Peinlichkeiten, dass die deutschen Behörden selbst offenbar keine Möglichkeiten zur Rettung von Patienten eröffnen möchten.
Das liegt ausschließlich an der mangelnden Herstellungserlaubnis für Phagenlabore durch das BfArM. Es wäre daher wünschenswert, wenn der Gesetzgeber die Zuständigkeit ausschließlich dem Paul-Ehrlich-Institut zuweisen würde.